-
Par mmajimel le 19 Mai 2011 à 11:47

Organisé par Jérôme Majimel, chargé de recherche au CNRS (Centre National de la Recherche Scientifique), le forum Carbone-Citoyen-Chercheur avait pour objectif de réunir le grand public et les acteurs de la recherche française pour discuter autour d'une préoccupation commune : le carbone, et plus précisément le dioxyde de carbone.
Cet événement a eu lieu le vendredi 13 et le samedi 14 mai à la maison écocitoyenne de Bordeaux et a réuni plus de 300 visiteurs.
A cette occasion, l'association des Olympiades de la Chimie a tenu un stand afin de :
- présenter au grand public une expérience sur la carboglace,
- Discuter avec le grand public du carbone et de l'eau,
- promouvoir les Olympiades de la Chimie en Aquitaine.
Retrouvez ci-dessous le contenu de ce stand...
Affiche sur la carboglace :
Affiche sur le carbone et l'eau :
Flyer des Olympiades de la Chimie en Aquitaine :
 votre commentaire
votre commentaire
-
Par mmajimel le 22 Mars 2011 à 14:46
Chaque année, une semaine est consacrée à la Fête de la Science.
Au cours de cette semaine, chercheurs, enseignants et étudiants vous présentent des expériences et expositions variées sur de nombreux thèmes scientifiques.
Afin de représenter les Olympiades de la Chimie et le thème "Chimie et Eau", un groupe d'étudiantes de l'ENSCBP a réalisé, les 19 et 21 octobre 2010, diverses expériences en relation avec ce thème.
Découvrez ces expériences et, pour certaines, réalisez les chez vous...

Expérience sur la tension de surface

1 saladier + eau + poivre + une touillete à café + liquide vaisselle
L'eau est constituée d'une multitude de molécules qui s'attirent entre elles. A la surface, ces molécules s'attirent encore plus que les autres : ce phénomène est appelé tension superficielle : cette tension est présente à la surface de l'eau. Donc si vous déposez délicatement la touillette sur l'eau, celle-ci va flotter car les molécules forment une sorte de couche à la surface de l'eau.
On ajoute le poivre qui va représenter chaque molécule de la surface.
On dépose ensuite avec le doigt une goutte de liquide vaisselle (détergent). les grains de poivre s'écartent alors du milieu et se dispersent sur les côtés. Le mouvement des grains de poivre représente donc le mouvement des molécules.
Le détergent crée une rupture entre les molécules au centre : elles s'attirent alors beaucoup moins qu'avant. Cependant, les molécules qui sont sur le bord et qui n'ont pas été en contact avec le détegent continuent à s'attirer de manière intense : elles vont donc entrainer celles du milieu vers elles, donc vers le bord.
Le détergent a donc diminué l'intensité de la tension superficielle lorsqu'il est entré en contact avec l'eau : les molécules s'attirent moins intensément.
Le détergent est appelé un agent tensio-acitf. Comme son nom l'indique, il agit sur la tension d'un liquide.

La surfusion de l'eau
Réalisation de l'expérience :
On place une petite bouteille d'eau minérale de 50 cL au congélateur. Sachant que la température de congélation de l'eau est de 0°C, on s'attend donc à ressortir du congélateur une bouteille d'eau congelée.
Après 2h30 passée au congélateur, on sort délicatement la bouteille. L'eau contenue dans la bouteille est à l'état liquide et pourtant la température est inférieure à 0°C. Ceci constitue la surfusion de l'eau.
On effectue ensuite un choc sur la bouteille qui engendre la congélation immédiate de l'eau.
Explication du phénomène :
La congélation est déclenchée par de petits germes solides en voie de congélation qui se propage à l'ensemble du système. Dans ce cas, l'agitation thermique entre les molécules d'eau engendre la fonte de ces germes et empêche ainsi la congélation. L'eau continue donc à se refroidir sans se solidifier.
Cependant, l'état de l'eau dans la bouteille est à l'état instable. La réalisation d'un chox sur la bouteille permet d'apporter l'énergie nécessaire pour débuter la congélation et engendrer la stabilisation du système. L'eau se retrouve donc à l'état solide.
L'eau peut se présenter sous forme surfondue pour des températures comprises entre 0 et -39°C.
Applications :
La majorité d'entre nous a déjà observé ce phénomène, notamment lors de la formation de verglas. En effet, la surfusion de l'eau explique les pluies verglaçantes où l'eau se transforme en glace au contact du sol.
Ce phénomène est également à l'origine de l'histoire sur les chevaux du lac Ladoga. Lors d'un temps très froid, des chevaux ont voulu traverser un lac. Sous l'effet des chocs créés par les chevaux, le lac se gela et les chevaux restèrent pris au piège.
Formation de gels physiques

Si l'on veut faciliter la compréhension du terme "polymère", on peut l'assimiler à un collier de perle. Soit un enchaînement de molécules (ici les billes) identiques. les polymères sont répandus dans tout notre quotidien, à commencer par les bouteilles en plastique, les monutres de lunettes ou encore les jantes de voitures...
On décide ici de synthétiser un gel chimique à partir de deux réactifs : l'alcool polyvinylique (PVA) obtenu par hydrolyse du polyacétate de vinyle et le tétraborate de sodium également appelé Borax. La réactions de ces deux polymères conduit à la formation d'un gel dit "physique". Le tétraborate de sodium est un sel basique qui se dissocie dans l'eau. En présence d'un polymère possédant des fonctions diol, la formation de liaisons hydrogène entre les ions borates et les hydroxyles conduit à la formation d'un réseau tridimensionnel caractértistique d'un gel.
Lors de l'ajout des deux réactifs, on met également quelques gouttes d'indicateur coloré, ici la phénolphtaléine, qui permet de visualiser la formation du gel. Cet indicateur coloré réagit uniquement en présence d'espèces basiques donc lors de l'ajout d'acide concentré (HCl par exemple), on constate la disparition de la couleur rose mais aussi et surtout la disparition du gel. l'acide chlorhydrique casse les liaisons hydrogène et donc le réseau tridimensionnel.
Une idée d'application de ces gels dans la vie courante ? Les couches pour bébé !

Expérience sur la densité

Très simple à réaliser : 1 saladier + 1 oeuf + eau + sel
En temps normal l'oeuf a une densité légèrement plus élevée que l'eau. c'est pourquoi, il coule lorsqu'on le met dedans.
Mais si on ajoute beaucoup de sel à l'eau, celle-ci devient plus dense. Ainsi, le sel augmente la densité de l'eau qui devient alors plus grande que celle de l'oeuf. L'oeuf se met à flotter dans l'eau car il est comme porté par celle-ci.
C'est comme la mère morte ! Celle-ci est très chargée en sel : on flotte donc quand on s'y baigne !
La carboglace

La carboglace est le nom donné au dioxyde de carbone sous forme solide. On le nomme également glace ou neige carbonique.
Elle est issue de la solidification du CO2 liquide à très basse température (-80°C) puis est ensuite comprimée pour obtenir cette glace.
Lorsque l'on dépose quelques glaçons de CO2 dans l'eau, ceux-ci se subliment directement. Ils passent donc de l'état solide à l'état de vapeur sans passer par l'état liquide.
On peut ainsi observer une fumée blanche et opaque se dégager du récipient et descendre vers le sol puisqu'elle est plus dense que l'air.
De plus, l'eau du récipient se refroidit car la sublimation du CO2 nécessite une grande quantité d'énergie puisée dans la chaleur de l'eau.
Cette carboglace trouve des applications aussi bien dnas le transport frigorifique que dans la conservation par le froid ou même les effets spéciaux. Le dioxyde de carbone sous forme solide est également présent en abondance aux pôles de la planète Mars où il forme les calottes glaciaires.

Retour sur la Fête de la Science
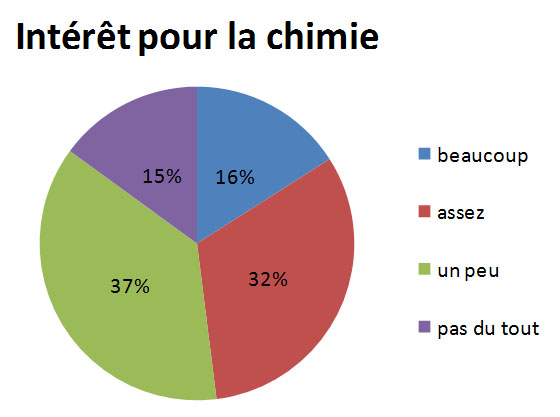
Afin de recueillir les impressions sur leur stand, les étudiantes de l'ENSCBP ont réalisé un questionnaires qui a été complété par 183 participants.
Une première question concernait la connaissance du concours des Olympiades de la Chimie. 94% des participants ne connaissaient pas le concours avant de voir le stand.
Une majorité de participants portait un intérêt pour le chimie avec un total de 69%.
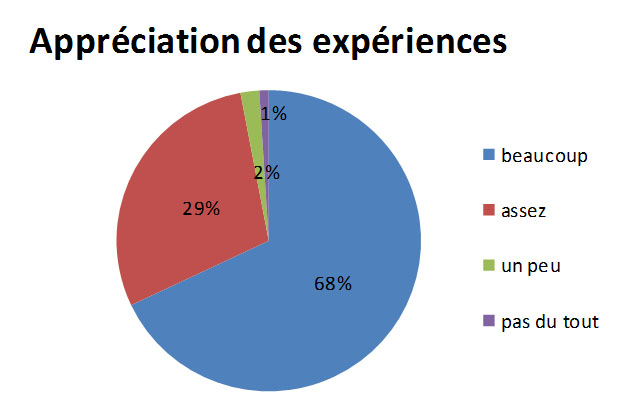
Les expériences ont été appréciées avec un total de 97%.
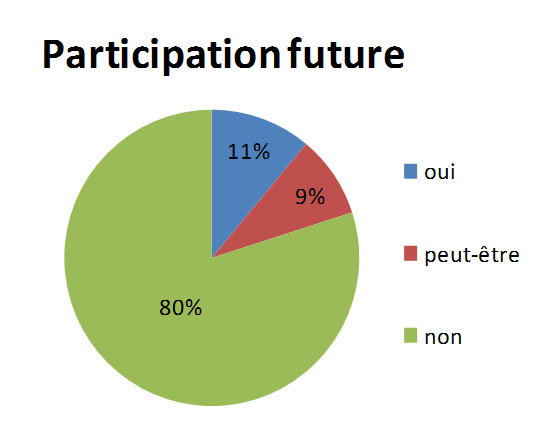
Au finaln 20% des participants seraient prêts à s'inscrire au concours des Olympiades de la Chmie.
 votre commentaire
votre commentaire Suivre le flux RSS des articles de cette rubrique
Suivre le flux RSS des articles de cette rubrique Suivre le flux RSS des commentaires de cette rubrique
Suivre le flux RSS des commentaires de cette rubrique
Olympiades de la Chimie d'Aquitaine Nord